Бета адреноблокатор для лечения глаукомы
Резюме
Цель: оценить гипотензивный эффект и влияние на проявления синдрома «сухого глаза» препарата Ксонеф БК в сравнении с терапией препаратом Бетоптик.
Цель: оценить гипотензивный эффект и влияние на проявления синдрома «сухого глаза» препарата Ксонеф БК в сравнении с терапией препаратом Бетоптик.
Методы: в исследование вошли пациенты с первичной открытоугольной глаукомой (ПОУГ) I–II стадий, были сформированы 2 группы пациентов, ранее получавшие терапию бетаксололом и не получавшие таковой. В обеих группах назначался Ксонеф БК 2 р./сут в течение 1 мес. ( в 1-й группе – после 4 нед. «отмывочного» периода).
Оценивали уровень внутриглазного давления (ВГД) по Маклакову, показатели контурной динамической тонометрии (тонометр Паскаль), тонометрии Iсare, пробы Норна и результаты конфокальной томографии роговицы с подсчетом плотности клеток в базальном слое эпителия.
Результаты: в 1-ю группу вошел 31 пациент (56 глаз), во 2-ю – 29 пациентов (53 глаза). Время разрыва слезной пленки увеличилось в сравнении с таковым при предшествующей терапии. Снижение ВГД от исходного уровня на фоне лечения препаратом Ксонеф БК достигало 23,7–24,2% в зависимости от метода измерения и соответствовало данным для оригинального препарата Бетоптик.
Заключение: препарат Ксонеф БК является эффективным в отношении снижения ВГД и может быть рекомендован для лечения пациентов с ПОУГ и сопутствующими проявлениями синдрома «сухого глаза».
Ключевые слова: бетаксолол, бензалкония хлорид, глаукома, синдром «сухого глаза».
Abstract
New forms of selective beta-adrenoblockers
in the treatment of glaucoma
Egorov E.A.
Russian National Research Medical University named after Pirogov N.I., Moscow
Purpose: to evaluate hypotensive effect of Xonef BK and its influence on symptoms of dry eye syndrome in comparison with Betoptic eye drops.
Мethods: patients with POAG of I-II stages were enrolled. 2 groups were formed, in one of which patients were receiving betaxolol previously and one – without any treatment, with newly dignosed POAG. In both groups Xonef BK was prescribed by 2 times per day during 1 month (in the 1st group – after a 4 weeks wash-out period). IOP measurement (Pascal, Maklakov and Icare methods), Norn test and confocal corneal tomography with counting of cell density in the basal epithelial layer were carried out.
Results: 31 patients (56 eyes) were included into the 1st group and 29 patients (53 eyes) – into the second one. Tear film breakup time increased in comparison with previously prescribed betaxolol treatment. IOP lowering after Xonef instillations was 23,7–24,2% from the baseline and was comparable to the IOP-lowering effect of the Betoptic.
Conclusion: Xonef BK is characterized by evident hypotensive effect and could be recommended for treatment of patients with POAG and dry eye syndrome.
Key words: betaxolol, benzalkonium chloride, glaucoma, dry eye syndrome.
Глаукома – одно из тяжелейших заболеваний глаза, требующее постоянной терапии для поддержания нормального уровня ВГД.
Кроме эффективности гипотензивной терапии для увеличения приверженности пациентов к лечению большое значение имеют хорошая переносимость препаратов и режим их назначения [1–4].
Блокаторы β-адренергических рецепторов относят к рекомендованным препаратам первого выбора. Селективные β1-адреноблокаторы представлены в ряду средств лечения глаукомы 0,5% офтальмологическим раствором бетаксолола. Изначально синтезированный для лечения сердечно-сосудистых заболеваний, бетаксолол в виде глазных капель применяется в офтальмологии для лечения ПОУГ и глазной гипертензии.
Бетаксолол снижает ВГД за счет уменьшения продукции внутриглазной жидкости, однако точные механизмы этого эффекта не изучены полностью до сих пор [5, 6]. Помимо этого, в процессе лечения наблюдается некоторое улучшение оттока водянистой влаги, хотя в большинстве исследований изменение оттока оказывается статистически недостоверным.
Бетаксолол лишен собственной симпатомиметической активности, имеет незначительную мембраностабилизирующую активность. Бетаксолол увеличивает скорость линейного кровотока в сосудах сетчатки и диска зрительного нерва, расширяет мелкие артерии и артериолы сетчатки и диска зрительного нерва животных и человека. В совокупности это приводит к улучшению кровотока в сетчатке и зрительном нерве, что является весьма актуальным, т. к. у больных глаукомой микроциркуляция, как правило, нарушена [6]. При длительном лечении бетаксололом наблюдается положительное влияние на состояние полей зрения. Это объясняется либо прямым нейропротекторным действием препарата, либо индуцированным бетаксололом увеличением кровотока в сосудах глаза. Бетаксолол также может проявлять свойства блокаторов кальциевых каналов, взаимодействуя с кальциевыми каналами L-типа. Это приводит к расширению сосудов и улучшению микроциркуляции в тканях глаза [7].
Гипотензивный эффект при закапывании бетаксолола развивается через 30 мин, достигает максимума через 2 ч и продолжается в течение 12 ч. Препарат снижает ВГД в среднем на 25% от исходного уровня.
При длительном назначении любых гипотензивных препаратов существует риск развития синдрома «сухого глаза» из-за вспомогательных веществ, в основном в результате воздействия консервантов. Бензалкония хлорид (БХ) в различных концентрациях используется в качестве консерванта для большинства гипотензивных глазных капель. БХ обладает раздражающим действием на ткани глаза и способствует большей выраженности клинических проявлений воспалительных заболеваний век, конъюнктивы, а также нарушений стабильности слезной пленки. Муцин, вырабатываемый бокаловидными клетками конъюнктивы, является важным компонентом, обеспечивающим стабильность слезной пленки. Длительное применение глазных препаратов с БХ может существенно уменьшать количество бокаловидных клеток [8]. Также БХ влияет на испаряемость водной части слезной пленки в результате повреждения липидного слоя [9]. Таким образом, новым направлением в разработке антиглаукомных глазных препаратов стал поиск решений для уменьшения выраженности побочных эффектов, в т. ч. синдрома «сухого глаза» с одновременным сохранением или повышением уровня их гипотензивного эффекта у пациентов с глаукомой.
В настоящий момент зарегистрированы 2 препарата бетаксолола: Ксонеф и Ксонеф БК (глазные капли), состав которых дополнен гипромеллозой. Взаимодействуя с естественной слезой, гипромеллоза оказывает кератопротективное действие, восполняет дефицит слезной жидкости и улучшает увлажнение роговицы. Гипромеллоза способствует восстановлению, стабильности и воспроизведению оптических характеристик слезной пленки.
Препарат Ксонеф включает в свой состав бетаксолол (5 мг), а также вспомогательные вещества. В качестве консерванта в данном препарате используется БХ, однако его действие сбалансировано наличием гипромеллозы, позволяющей уменьшить возможные проявления его негативного действия на слезопродукцию и время разрыва слезной пленки и, таким образом, улучшить переносимость препарата при сохранении его максимальной эффективности [10].
В дальнейшем был разработан Ксонеф БК – улучшенная (без консерванта) лекарственная форма препарата. При ее создании учитывались предыдущий опыт и данные об эффективности и безопасности препаратов бетаксолола при длительном лечении пациентов с глаукомой. Из состава Ксонефа БК исключен консервант, в качестве действующего вещества присутствует бетаксолол – в виде бетаксолола гидрохлорида (5 мг), также включена гипромеллоза (2 мг). Для удобства применения Ксонеф БК выпускается в одноразовых тюбиках-капельницах по 0,4 мл.
Целью нашего исследования было оценить гипотензивный эффект и профиль безопасности Ксонефа БК и сравнить с терапией оригинальным препаратом Бетоптик по гипотензивному эффекту и влиянию на проявления синдрома «сухого глаза».
Методы
В исследование вошли пациенты с ПОУГ I–II стадий с высокой остротой зрения (не менее 0,5), без сопутствующих заболеваний сетчатки и зрительного нерва, тяжелой соматической патологии и врожденных аномалий строения ДЗН (инверсия ДЗН, псевдоневрит, миелиновые волокна, друзы ДЗН). Уровень ВГД без гипотензивной терапии не превышал 30 мм рт. ст. (по Маклакову).
На этапе включения для верификации диагноза проводились рутинное обследование, компьютерная периметрия, пахиметрия. Оценивался соматический статус пациентов по данным анамнеза и уровню АД и ЧСС.
Были сформированы 2 группы пациентов. В 1-ю группу вошел 31 пациент (56 глаз), ранее получавший терапию бетаксололом 0,5% (Бетоптик). Средний возраст составил 62 года. Средняя площадь ДЗН составила 2,23 мм2, среднее значение показателя MD = — 2.54 dВ. Уровень ВГД без терапии (по Маклакову) – от 24 до 30 мм рт. ст. Средние значения центральной толщины роговицы были 545 мкм. В этой группе определялся исходный уровень ВГД, проводились проба Норна и конфокальная томография роговицы с подсчетом плотности клеток в базальном слое эпителия. После 4 нед. «отмывочного» периода оценивали уровень ВГД по Маклакову, показатели контурной динамической тонометрии (тонометр Паскаль), тонометрии Iсare, назначали терапию препаратом Ксонеф БК (2 р./сут в течение 1 мес.) и повторно проводили пробу Норна и конфокальную томографию роговицы с подсчетом плотности клеток в базальном слое эпителия.
Во 2-ю группу вошли 29 (53 глаза) пациентов с впервые выявленной глаукомой, ранее не получавших антиглаукоматозной терапии. Средний возраст составил 63 года. Средняя площадь ДЗН была 2,24 мм2, среднее значение MD = — 2.79 dВ. Уровень ВГД без терапии (по Маклакову) варьировал от 24 до 30 мм рт. ст. Среднее значение центральной толщины роговицы – 557 мкм. Пациентам этой группы проводился суточный мониторинг артериального давления до назначения исследуемого препарата и через 1 мес. после лечения.
Результаты
При анализе результатов лечения в 1-й группе оценивался уровень офтальмотонуса с исходным применением терапии, без нее и на фоне лечения препаратом Ксонеф БК.
Результаты отличались в зависимости от метода тонометрии. Так, на фоне терапии препаратом Ксонеф БК снижение ВГД по результатам тонометрии по Маклакову составило в среднем 6,3 мм рт. ст. (на 23,7% от уровня ВГД без терапии), по результатам тонометрии на тонометре Раscal – 5,8 мм рт. ст. (на 24,1% от уровня ВГД без терапии), на тонометре Iсаrе – 5,6 мм рт. ст. (на 24,2% от уровня ВГД без терапии).
Помимо оценки гипотензивного эффекта проводился анализ времени разрыва слезной пленки у пациентов на фоне терапии препаратами Бетоптик и Ксонеф БК. Различие было достоверным (р<0,05).
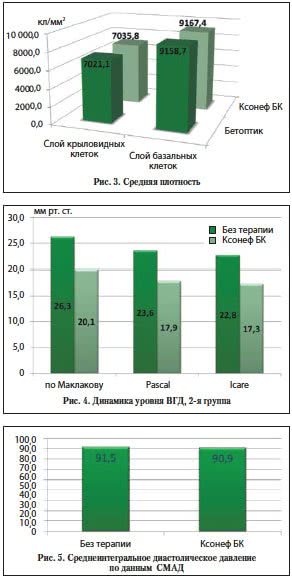
Сравнение выбранных вариантов терапии по данным конфокальной томографии роговицы также выявило небольшое увеличение количества эпителиальных клеток на единицу площади, однако отличия оказались статистически недостоверны (р>0,05).
Во 2-й группе cнижение ВГД по результатам тонометрии по Маклакову составило в среднем 6,2 мм рт. cт. (на 23,3% от исходного), по результатам динамической контурной тонометрии на тонометре Раsсаl – 5,8 мм рт. cт. (на 24,1% от исходного), на тонометре Iсаrе – 5,4 мм рт. cт. (на 23,6% от исходного) (рис. 4).
Для оценки системного действия препарата Ксонеф БК сравнивалось среднеинтегральное диастолическое давление до назначения терапии и на ее фоне. Статистически значимого снижения выявлено не было (р>0,05) (рис. 5).
Выводы
1. Снижение ВГД от исходного уровня на фоне лечения препаратом Ксонеф БК достигало 23,7–24,2% в зависимости от метода измерения и соответствовало данным для оригинального препарата Бетоптик.
2. Ксонеф БК оказывает меньшее отрицательное влияние на проявления синдрома «сухого глаза» в сравнении с препаратом Бетоптик, что может быть обусловлено отсутствием в препарате Ксонеф БК консерванта. Время разрыва слезной пленки увеличилось в сравнении с таковым при предшествующей терапии. Отсутствие статистически достоверного влияния на плотность эпителиальных клеток может быть результатом короткого периода наблюдения.
3. Неблагоприятного влияния препарата на показатели системного кровотока по данным суточного мониторинга артериального давления не обнаружено.
Заключение
Препарат Ксонеф БК является эффективным в отношении снижения ВГД и может быть рекомендован для лечения пациентов с ПОУГ и сопутствующими проявлениями синдрома «сухого глаза».

Литература
1. Куроедов А.В. Перспективы применения комбинированных антиглаукомных препаратов (обзор литературы) // Клиническая офтальмология. 2007. Т. 8. № 4. С. 176–180.
2. European Glaucoma Society – Terminology & Guidelines for Glaucoma (European Guidelines). Glaucoma Society. 2nd ed. Savona Italy: Editrice DOGMA, 2003. Vol. 3. Р. 3–26.
3. Schwartz G.F. Compliance and persistency in glaucoma follow-up treatment // Curr.Opin Ophthalmol. 2005. Vol. 16. Р. 114–121.
4. Hitchings R. Impotance of Compliance in the management of glaucoma //Abstract book. Symposium “Glaucoma”, Rome, Italy, 1999. January 29-31. P. 20.
5. Алексеев В.Н., Харьковский А.О., Егоров Е.А. Бетаксолол в лечении глаукомы // РМЖ. 2001. № 2. С. 58–59.
6. Wax M.B., Molinoff P.B. Distribution and properties of beta–adrenergic receptors in human iris/ciliary body // Invest Ophthalmol Vis Sci. 1987 Mar. Vol. 28. N 3. P. 420–430.
7. Osborne N. et al. Topically applied betaxolol attenuates NMDA–induced toxicity to ganglion cells and the effects of ischaemia to the retina // Exp. Eye Res. 1999. N 69. P. 333–342.
8. Pisella P.J., Debbasch C., Hamard P., Creuzot-Garcher C., Rat P., Brignole F., Baudouin C. Conjunctival proinflammatory and proapoptotic effects of latanoprost and preserved and unpreserved timolol: an ex vivo and in vitro study // Invest. Ophthalmol. Vis. Sci. 2004. Vol. 45. Р. 1360–1368.
9. Dry Eye Work Shop. The epidemiology of dry eye disease: report of the Epidemiology Subcommittee of the International Dry Eye Work Shop (2007). Ocul. Surf. 2007. Vol. 5. Р. 93–107.
10. Алешаев М.И., Зарубина О.А., Голикова М.С. Ксонеф при лечении больных с впервые выявленной открытоугольной глаукомой: Сб. тез. IX Всерос. науч.-практ. конф. с межд. участием «Федоровские чтения – 2011» / под общ. ред. Х.П. Тахчиди. М.: Офтальмология, 2011. 410 с.
Источник
Резюме
Авторы проводят анализ безопасности и эффективности местных бета-адренергических препаратов для лечения глаукомы. Особое внимание уделено пролонгированным лекарственным формам тимолола малеата.
Авторы проводят анализ безопасности и эффективности местных бета-адренергических препаратов для лечения глаукомы. Особое внимание уделено пролонгированным лекарственным формам тимолола малеата.
Ключевые слова: глаукома, бета-адреноблокаторы, тимолола малеат, Тимолол гель.
Abstract
Beta-blockers in treatment of glaucoma.
Back to the future. Literature review
Egorov E.A., Egorov A.E.
RNRMU named after I.N. Pirogov
Authors analyze effectiveness and safety of topical beta-adrenergic drugsfor treatment of glaucoma. Particular attention is paid to prolonged formof timolol maleate.
Key words: glaucoma, beta-adrenoblockers, timolol maleate, Timolol gel.
Глаукома относится к хроническим заболеваниям, требующим постоянного лечения. Консервативное лечение глаукомы подразумевает назначение местных гипотензивных препаратов в течение длительного времени для поддержания нормального уровня внутриглазного давления (ВГД).
Безопасность и хорошая переносимость гипотензивных лекарственных средств имеют основное значение для соблюдения пациентами рекомендаций врача и режима применения данных препаратов и, как следствие, поддержания зрительных функций больных глаукомой [6, 15, 25].
Выбор препаратов для консервативного лечения больного глаукомой зависит от ее формы и сопутствующих заболеваний. Также нужно учитывать особенности механизма действия, фармакодинамики и состав назначаемых препаратов. Офтальмологические препараты могут вызывать не только местные, но и системные побочные реакции в результате абсорбции в кровяное русло [32].
В последние годы в литературе уделяется огромное внимание такому понятию, как приверженность к лечению [17]. Она непосредственно связана с режимом дозирования и длительностью лечения. Чем чаще в течение дня пациент должен закапывать препарат, тем больше вероятность того, что режим дозирования будет нарушен [18].
Появление в конце 1970-х гг. бета-адреноблокаторов в виде глазных лекарственных форм стало большим шагом вперед в лечении глаукомы. В течение последних лет блокаторы бета-адренергических рецепторов относят к рекомендованным препаратам первого выбора [3, 4]. Основное место среди них занимает тимолола малеат [7].
При лечении местными бета-адреноблокаторами могут наблюдаться как местные, так и системные побочные эффекты. К наиболее частым системным проявлениям относят реакции со стороны дыхательной и сердечно-сосудистой систем (колебания частоты сердечных сокращений и уровня артериального давления). Степень выраженности, а также частота проявления системных побочных эффектов местных бета-блокаторов обусловлены особенностями их фармакокинетики. При местном применении тимолола малеат не подвергается первичному метаболизму в печени, что приводит к его значительной концентрации в плазме крови и повышению риска системных побочных реакций [14, 35]. После инстилляции около 80% количества глазных капель попадает в системный кровоток. Учитывая то, что 0,5% раствор тимолола малеата применяется 2 р./сут, можно предположить, что это количество, соответствующее 200 мкг действующего вещества, будет увеличивать риск развития серьезных побочных реакций [25].
Одним из путей уменьшения частоты и выраженности побочных эффектов бета-блокаторов является назначение их пролонгированных форм, в частности пролонгированной формы тимолола малеата. Это позволяет достичь и поддерживать оптимальную эффективную концентрацию активного вещества на протяжении длительного времени.
В России мультицентровое исследование пролонгированной лекарственной формы тимолола малеата было проведено в 1998 г. в 7 офтальмологических центрах с участием 111 больных (161 глаз) с ПОУГ или глазной гипертензией.
Пациентам назначался 0,5% раствор пролонгированного тимолола малеата (Тимоптик-депо) 1 р./сут. В случае, если после 4 и 8 нед. монотерапии Тимоптиком-депо уровень истинного ВГД оставался выше 21 мм рт. ст., пациентам назначалась дополнительная терапия. Эффективность монотерапии Тимоптиком-депо оценивалась на основании данных об уровне офтальмотонуса через 4 нед. применения препарата у тех пациентов, монотерапия у которых оказалась неэффективной (50 глаз), и данных измерения ВГД, полученных при осмотре через 8 нед. лечения (111 глаз). Средний уровень ВГД при завершении лечения Тимоптиком-депо составил 18,5±5,5 мм рт. ст. В среднем уровень офтальмотонуса снизился на 7,3±5,1 мм рт. ст. (р<0,01) (рис. 1).
Исследование полей зрения показало, что на фоне проводимой терапии в течение 12 нед. уменьшилась частота регистрации абсолютных и относительных скотом. Снизилось также и максимальное число относительных скотом, выявляемых при обследовании одного глаза.
На фоне применения Тимоптика-депо в течение 12 нед. не наблюдалось значительного изменения уровня артериального давления. Отмечалось умеренно выраженное изменение частоты сердечных сокращений. За весь период исследования у 6 (5,41%) пациентов была выявлена клинически значимая синусовая брадикардия. Применение Тимоптика-депо 1 р./сут позволяло контролировать уровень офтальмотонуса и уменьшить амплитуду его колебаний в течение суток. Пролонгированная форма тимолола малеата оказывала менее выраженное влияние на частоту сердечных сокращений по сравнению с его водным раствором [11].
Эффективность и безопасность Тимоптика-депо были также изучены в сравнении с эффективностью и безопасностью 0,5% раствора бетаксолола и 0,5% раствора тимолола малеата [1, 2]. В исследование были включены здоровые добровольцы и больные первичной открытоугольной глаукомой (ПОУГ). Всего было обследовано 230 человек (368 глаз). Через 8 нед. лечения Тимоптик-депо демонстрировал наибольшую эффективность в сравнении с 0,5% раствором тимолола и 0,5% раствором бетаксолола.
Другой препарат пролонгированного действия – Ниолол гель 0,1%, включающий тимолол в сочетании с карбомером для доставки действующего вещества, был изучен в нескольких исследованиях в сравнении с 0,5% водным раствором тимолола малеата [20, 26, 28, 33]. Местная концентрация обоих препаратов была сравнима (рис. 2).
Было отмечено, что через 8 нед. применения препаратов снижение ВГД в обеих группах было сравнимым [26, 28]. Статистически значимым было значение остаточного снижения ВГД по истечении более 24 ч с момента инстилляции Ниолол геля. Таким образом, длительность действия новой формы тимолола превосходила таковую 0,5% водного раствора в 5 раз [20].
Было также проведено 4-недельное сравнительное исследование у 32 пациентов (64 глаза) с ПОУГ фиксированной комбинации аналогов простагландина и водного раствора 0,5% тимолола малеата (латанопрост+тимолол, травопрост+тимолол, биматопрост+тимолол) с нефиксированной комбинацией аналогов простагландина: латанопроста, травопроста и биматопроста и 0,1% тимолола в гелевой форме. Во всех группах снижение уровня ВГД было более выражено и статистически значимо (p<0,001) при назначении нефиксированной комбинации с пролонгированной формой тимолола малеата. Назначение 0,1% тимолола в гелевой форме также позволило увеличить число пациентов с суточными колебаниями ВГД ≤ 2 мм рт. ст. [12].
Относительно частоты и выраженности системных побочных эффектов сравнительные исследования 0,5% раствора тимолола и 0,1% тимолола в виде гидрогеля показали, что уровень артериального давления, частота сердечных сокращений, изменения интервала QT и PR менее подвержены изменениям при назначении пролонгированной формы тимолола [1, 2, 12, 16, 20, 21, 26, 28]. Наряду с этим некоторые исследователи сообщают о сравнимой безопасности в отношении двух лекарственных форм тимолола [22].
Благодаря медленной абсорбции тимолола из данной лекарственной формы он определяется в плазме крови в меньших концентрациях, чем обычный раствор тимолола малеата [5]. В ряде исследований было показано, что гипотензивный эффект при однократном применении 0,1% пролонгированной формы сравним с эффектом при двукратном назначении 0,5% концентрации обычного раствора тимолола малеата или превосходит его [12, 20]. При этом гелевая форма тимолола малеата оказывает менее выраженное влияние на частоту сердечных сокращений по сравнению с его водным раствором [1, 2, 5, 12, 13, 16, 19–21, 23, 26, 28, 34] (рис. 2). Таким образом, при аналогичной эффективности применение пролонгированной формы тимолола малеата связано с меньшим числом побочных эффектов системного характера. Это также способствует снижению стоимости лечения [26].
Недавно появившийся на рынке новый препарат тимолола малеата в виде глазного геля Офтан® Тимогель содержит в своем составе вспомогательные вещества: карбомер, сорбитол и поливиниловый спирт. Они позволили уменьшить концентрацию активного компонента (тимолола малеата) без ущерба для его эффективности и увеличить продолжительность местного гипотензивного действия. Как следствие, улучшилась местная и системная переносимость препарата.
На этапе разработки препарата и в постмаркетинговый период было проведено несколько рандомизированных контролируемых, а также открытых наблюдательных клинических исследований при общем участии около 1200 пациентов [24, 26, 30]. Согласно полученным результатам, Офтан® Тимогель при закапывании 1 р./сут не уступал по эффективности глазным каплям 0,5% тимолола малеата в стандартной дозировке 2 р./сут (рис. 4).
Также было отмечено, что уменьшение концентрации активного компонента в препарате приводит к 5–10-кратному снижению концентрации тимолола в плазме крови по сравнению со стандартным режимом применения глазных капель 0,5% тимолола или комбинированных глазных капель латанопроста и тимолола [24, 29, 30].
Снижение концентрации тимолола в плазме крови напрямую коррелировало с более низкой частотой системных побочных эффектов. В частности, было установлено, что Офтан® Тимогель оказывает значимо меньшее влияние на частоту сердечных сокращений, чем глазные капли 0,5% тимолола. Оценивалась динамика частоты сердечных сокращений при ортостатической пробе [29, 30]. В норме частота сердечных сокращений после перехода из горизонтального положения в вертикальное увеличивается, а после перехода из вертикального положения в горизонтальное – уменьшается. Эта зависимость сохранялась при проведении ортостатической пробы на фоне применения глазного геля Офтан® Тимогель, в то время как на фоне инстилляций глазных капель 0,5% тимолола наблюдалась статистически значимая депрессия частоты сердечных сокращений по сравнению с исходными данными (рис. 5).
Как известно, в большинстве случаев для гипотензивных глазных капель в качестве консерванта используется бензалкония хлорид в различных концентрациях. Токсическое действие бензалкония хлорида зависит от его концентрации и времени экспозиции и в наибольшей степени проявляется при продолжительном лечении, каковым и является лечение глаукомы. Бензалкония хлорид в составе глазных капель при длительном применении оказывает повреждающее действие на липидный слой слезной пленки, уменьшает слезопродукцию, а также нарушает структуру эпителия роговицы, способствует апоптозу бокаловидных клеток конъюнктивы и увеличению риска хронических воспалительных заболеваний глаза. Учитывая вышесказанное, пациентам с глаукомой рекомендуется назначение препаратов с минимальной возможной концентрацией консерванта или без него.
Количество консерванта в Офтан® Тимогеле составляет 0,05 мг на 1 г препарата, то есть снижено вдвое по сравнению с 0,5% раствором тимолола малеата. Это обусловливает лучшую местную переносимость гелевой формы тимолола по сравнению с глазными каплями. При переводе пациентов с глазных капель 0,5% тимолола на Офтан® Тимогель достоверно сокращались жалобы на зуд, слезотечение, жжение и чувство инородного тела в глазу [26]. При назначении пациентам, ранее получавшим лечение Офтан® Тимогелем, глазных капель 0,05% тимолола малеата отмечалась большая выраженность местных побочных реакций (рис. 6).
Назначение бета-блокаторов в качестве препаратов первого выбора оправданно с экономической и терапевтической точки зрения. Однако следует учитывать риск возникновения системных побочных эффектов, что может упускаться врачом из виду при назначении местных препаратов. Особое внимание требуется при лечении пожилых пациентов в связи с наличием у них сопутствующих хронических заболеваний сердечно-сосудистой и дыхательной системы.
Применение пролонгированных форм тимолола малеата у пациентов с ПОУГ и глазной гипертензией приводит к выраженному снижению уровня ВГД, которое сравнимо или даже превосходит таковое при терапии 0,5% водным раствором тимолола малеата, а также к менее значимым колебаниям ВГД в течение суток. Благодаря низкой концентрации в плазме крови удается уменьшить и частоту, и интенсивность побочных реакций со стороны органов дыхания и сосудистой системы. Однократное применение в течение дня пролонгированных лекарственных форм тимолола, таких как Офтан® Тимогель, способствует увеличению приверженности пациентов к лечению, а значит, и его эффективности. Также следует отметить снижение затрат на лечение вследствие измененного режима дозирования и уменьшения расходования препарата. Все вышеперечисленное позволяет отнести пролонгированную лекарственную форму тимолола малеата Офтан® Тимогель к эффективным и безопасным средствам лечения глаукомы, обладающим значительными преимуществами перед существующими формами тимолола малеата 0,25 и 0,5%.
Литература
1. Егоров Е.А., Хлобыстов А.А., Ставицкая Т.В., Бродская М.В., Бишеле Н.А. Сравнительное изучение эффективности и безопасности бетаксолола, тимолола малеата и тимоптика-депо: Материалы 11-й научно-практ. конф. «Новые технологии микрохирургии глаза», 14–16 сентября 2000 г., Оренбург. С. 74–77.
2. Егоров Е.А., Ставицкая Т.В., Хлобыстов А.А. Сравнительное изучение влияния бетаксолола, тимолола малеата и тимоптика-депо на офтальмотонус, гемодинамику глаза и проводимость миокарда: Материалы VII съезда офтальмологов России, 16–20 мая 2000 г., Москва. Ч. 1. С. 122.
3. Егоров Е. А. и соавт. Офтальмофармакология. М.: ГЭОТАР-Мед, 2004.
4. Еричев В.П. Основные направления гипотензивного лечения больных первичной глаукомой // Рус. офтальмол. журн. 2000. Т. 1. № 1. С. 18–21.
5. Еричев В.П., Якубова Л. В. Эффективность и безопасность использования тимоптик-депо в гипотензивной терапии глаукомы // Вестник офтальмологии. 1998. Т. 114. № 1. С. 8–9.
6. Куроедов А.В. Перспективы применения комбинированных антиглаукомных препаратов (обзор литературы) // Клиническая офтальмология. 2007. Т. 8. № 4. С. 176–180.
7. Нестеров А.П. Актуальные проблемы терапии глаукомы: Материалы симпозиума «Применение фотила и фотила форте в свете современных принципов лечения глаукомы». М.,1996. C. 3–4.
8. Нестеров А.П. Глаукома. М.: Медицина, 1995.
9. Нестеров А.П. Общая оценка и выбор методов лечения глаукомы;: Сб. науч. тр. «Физиология и патология внутриглазного давления». М., 1987. С. 60–68.
10. Нестеров А.П. Первичная глаукома. М.: Медицина, 1973.
11. Нестеров А.П., Егоров Е.А., Астахов Ю.С., Волков В.В. и др. Тимоптик-Депо: многоцентровое исследование эффективности и безопасности // Medical Market. 1999. Vol. 2. № 32. P. 39–41.
12. Nucci C., Varesi C., Martucci A., Cesareo M., Cedrone C., Mancino R., Cerulli L. Efficacy of timolol 0.1% gel and a prostaglandin analog in an unfixed combination compared to the corresponding fixed combinations // Eur J Ophthalmol. 2013. Vol. 5. Р. 683–689.
13. Dickstein K., Aarsland T. Comparison of the effects of aqueous and gellan ophthalmic timolol оп peak exercise performance in middle-aged men // Am-J-Ophthalmol. 1996 Apr. Vol. 121 (4). Р. 367–371.
14. Edeki T.I., He H., Wood A.J. Pharmacogenetic explanation for excessive beta-blockade following timolol eye drops. Potential for oralophthalmic drug interaction // J. Am. Med assoc. 1995. Vol. 274. Р. 1611–1613.
15. European Glaucoma Society – Terminology & Guidelines for Glaucoma (European Guidelines). Glaucoma Society. 2nd ed. Savona Italy: Editrice DOGMA, 2003. Vol. 3. Р. 3–26.
16. Uusitalo H., Ka..ho..nen M., Ropo A., Ma..enpa..a.. J., Bja..rnhall G., Hedenstro..m H., Turjanmaa V. Improved systemic safety and risk–benefit ratio of topical 0.1% timolol hydrogel compared with 0.5% timolol aqueous solution in the treatment of glaucoma // Graefe’s Arch Clin Exp Ophthalmol.
17. Hitchings R. Impotance of Compliance in the management of glaucoma //Abstract book. Symposium “Glaucoma”, Rome, Italy, 1999. January 29-31. P. 20.
18. Hosoda M., Yamabayashi S., Furuta M., Tsukahara S. Do glaucoma patients use eye drops correctly? // J. of Glaucoma, June 1995. Vol. 4. No. 3. P. 202–206.
19. Kanellopoulos A.J., Perry H.D., Donnenfeld E.D. Comparison of topical timolol gel to oral acetazolamide in the prophylaxis of viscoelastic-induced ocular // Cornea. 1997 Jan. Vol.16 (1). Р. 12–15.
20. Mayer H., von der Ohe N. Efficacy of a novel hydrogel formulation in human volunteers // Ophthalmologica. 1996. Vol. 210 (2). Р. 101–103.
21. Nino J. et al. Cardiovascular effects of ophthalmic 0.5% timolol aqueous solution and 0.1% timolol hydrogel // Clin Physiol Funct Imaging. 2002 Jul. Vol. 22 (4). Р. 271–278.
22. Quaranta L. et al. Circadian intraocular pressure and blood pressure reduction with timolol 0.5% solution and timogel 0.1% in patients with primary open-angle glaucoma // J Clin Pharmacol. 2012 Oct. Vol. 52 (10). Р. 1552–1557.
23. Rosenlund E.F. The intraocular pressure lowering effect of timolol in gel-forming solution // Acta-Ophthalmol-Scand. 1996 Apr. Vol. 74 (2). Р. 160–162.
24. Rouland J.-F. et al. Timolol 0.1% gel once daily versus conventional timolol 0.5% solution twice daily: A comparison of efficacy and safety // Ophthalmologica. 2002. Vol. 216. Р. 449–454.
25. Schwartz G.F. Compliance and persistency in glaucoma follow-up treatment // Curr.Opin Ophthalmol. 2005. Vol. 16. Р. 114–121.
26. Stankiewicz A. et al. A multicenter, observative, non-invasive study of the tolerance of Nyolol gel 0,1% in ocular hypertensive patients // Klinika Oczna. 2004. Vol. 106. Р. 644–647.
27. Stewart W.C., Sine C., Cate E., Minno G.E., Hunt H.H. Daily cost of beta-adrenergic blocker therapy // Arch Ophthlmol. 1997, Jul. Vol. 115 (7). Р. 853–856.
28. Uusitalo H. et al. Evaluation of efficacy and systemic side effects of topical 0.1% timolol gel and 0.5% aqueous timolol maleate // SOE Abstract. 1999. P 353.
29. Uusitalo H. et al. Efficacy and systemic side-effects of topical 0.5% timolol aqueous solution and 0.1% timolol hydrogel // Acta Ophthalmol Scand. 2005. Vol. 83. Р. 723–728.
30. Uusitalo H. et al. Improved systemic safety and risk-benefit ratio of topical 0.1% timolol hydrogel compared with 0.5% timolol aqueous solution in the treatment of glaucoma // Graefe’s Arch Clin Exp Ophthalmol. 2006. Vol. 244. Р. 1491–1496.
31. Uusitalo R. Comparative study on the effect of two timolol preparation in glaucoma // VOX Glaucoma.1995. Vol. 17. No.1. P. 33–35.
32. Valuck J.R., Perlman J.I., Anderson C., Wortman G.I. Co-prescribing of medications used to treat obstructive lung disease, congestive heart failure and depression among users of topical beta blockers: estimates from three US Veterans Affairs Medical Centers // Pharmacoepidemiology and drug safety. 2001. Vol. 10. Р. 511–516.
33. Von der Ohe N., Stark M., Mayer H., Brewitt H. How can the bioavailability of timolol be enhanced? A pharmacokinetic pilot study of novel hydrogels // Graefes Arch Clin Exp Ophthalmol. 1996 Jul. Vol. 234 (7). Р. 452–456.
34. Yamamoto T., Kitazawa Y., Azuma I., Tsukahara S., Nakashima M. Clinical evaluation of a new formula of timolol maleate (WP-934 ophthalmic solution) // Jpn-J-Ophthalmol. 1997 Jul-Aug. Vol. 41 (4). Р. 244–250.
35. Yarangumeli A., Kural G. // Expert Opin. Pharmacother. 2004 May. Vol. 5 (5). Р. 1071–1081.
Источник

